cho 3g hỗn hợp X gồm Fe3O4 và Cu vào cốc chứa dd HCl dư . Sau khi các pư xảy ra hoàn toàn thấy còn lại 0,04 g chất rắn không tan . Tính % khối lượng Cu trong hỗn hợp X
+++Mọi người giúp em với ạ+++
cho 3g hỗn hợp X gồm Fe3O4 và Cu vào cốc chứa dd HCl dư . Sau khi các pư xảy ra hoàn toàn thấy còn lại 0,04 g chất rắn không tan . Tính % khối lượng hỗn hợp X
mọi người giải giúp em với ạ
- Chất rắn không tan là Cu
\(\Rightarrow\) %Cu = \(\dfrac{0,04.100}{3}\) \(\approx\) 1,3%
\(\Rightarrow\) %Fe3O4 = \(\dfrac{\left(3-0,04\right).100}{3}\) \(\approx\) 98,7%
Cho a gam hỗn hợp X gồm Fe2O3, Fe3O4, Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp X bằng H2 dư, thu được 42 gam chất rắn. Tính % khối lượng Cu trong hỗn hợp X
A. 25,6%.
B. 50%.
C. 44,8%.
D. 32%.
Cho a gam hỗn hợp X gồm Fe2O3, Fe3O4, Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp X bằng H2 dư, thu được 42 gam chất rắn. Tính phần trăm khối lượng Cu trong hỗn hợp X?
A. 25,6%.
B. 50%.
C. 44,8%.
D. 32%.
Cho 18.7g hỗn hợp X gồm Mg, Cu, Fe vào dung dịch HCl dư , sau khi phản ứng xảy ra hoàn toàn thì được dung dịch Y, còn lại 0.3g chất rắn không tan và thấy thoát ra 11.2 lít khí.
a) TÍnh khối lượng mỗi kim loại trong hỗn hợp X ban đầu?
b) Đem 0.3g chất rắn không tan sau phản ứng cho tác dụng với H2SO4 đặc nóng (vừa đủ) thì thoát ra V lít khí. Tính V?
a) Theo đề bài: \(m_{Cu}=0,3\left(g\right)\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
a______2a______a_____a (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b_____2b______b____b (mol)
Ta lập được hệ phươn trình: \(\left\{{}\begin{matrix}24a+56b=18,7-0,3=18,4\\a+b=\dfrac{11,2}{22,4}=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,3\cdot24=7,2\left(g\right)\\m_{Fe}=0,2\cdot56=11,2\left(g\right)\end{matrix}\right.\)
b) PTHH: \(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
Ta có: \(n_{Cu}=\dfrac{0,3}{64}=\dfrac{3}{640}\left(mol\right)=n_{SO_2}\) \(\Rightarrow V_{SO_2}=\dfrac{3}{640}\cdot22,4=0,105\left(l\right)\)
a)
Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(mol)$
$m_X = 24a + 56b = 0,3 = 18,7(gam)$
Suy ra a = 0,3 ; b = 0,2
$m_{Mg} = 0,3.24 = 7,2(gam)$
$m_{Fe} = 0,2.56 = 11,2(gam)$
b)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$n_{SO_2} = n_{Cu} = \dfrac{0,3}{64}$
$V = \dfrac{0,3}{64}.22,4 = 0,105(lít)$
Cho a gam hỗn hợp X gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư, thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp X bằng CO dư thu được 42 gam chất rắn. Phần trăm khối lượng của Cu trong hỗn hợp X là
A. 25,6%
B. 32,0%
C. 50,0%
D. 44,8%
Đáp án D
Các phản ứng xảy ra:
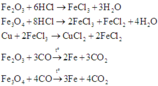
Nhận thấy: nO giảm = n O ( X ) = 1 2 n H C l = 0 , 5
⇒ a = m r ắ n s a u p h ả n ứ n g + m O g i ả m = 50 ( g a m )
Để tính được phần trăm khối lượng của Cu trong hỗn hợp X ta cần biết thêm khối lượng của Cu trong X.
Khi cho X vào dung dịch HCl dư thì chất rắn không tan còn lại sau phản ứng là Cu dư.
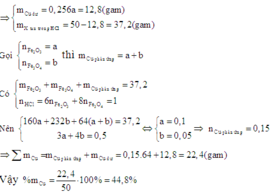
hoà tan 11 36g hỗn hợp x gồm FeO, Cu, Fe3O4 trong dd hcl sau pư thu được dd y chỉ chứa các muối tan có khối lượng 15,4g và 2,56g chất rắn ko tan. cho dd y td với AgNO3 dư,sau pư thu đc m g chất rắn ko tan, tìm m
Bước 1: Tính khối lượng chất rắn có trong dd y ban đầu: Khối lượng chất rắn tan trong dd y = Khối lượng dd y - Khối lượng các muối tan = 15,4g + 2,56g = 17,96g
Bước 2: Tính số mol các chất trong dd y: Số mol Cu = Khối lượng Cu / Khối lượng mol Cu = 2,56g / 63,55g/mol Số mol Fe3O4 = Khối lượng Fe3O4 / Khối lượng mol Fe3O4 = (17,96g - 2,56g) / (55,85g/mol + 3 x 16g/mol) Số mol FeO = Số mol Fe3O4 / 3
Bước 3: Xác định phản ứng giữa dd y và AgNO3: Phản ứng xảy ra giữa Cu và AgNO3 theo phương trình: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Bước 4: Tính số mol AgNO3 cần để phản ứng hoàn toàn với Cu: Số mol AgNO3 = 2 x Số mol Cu
Bước 5: Tính khối lượng chất rắn không tan thu được sau phản ứng với AgNO3: Khối lượng chất rắn không tan = Số mol AgNO3 x Khối lượng mol AgNO3
Bước 6: Tính m: m = Khối lượng chất rắn không tan sau phản ứng với AgNO3 - Khối lượng chất rắn không tan ban đầu
Lưu ý: Trong quá trình tính toán, cần sử dụng đúng các khối lượng mol của các chất và phương trình phản ứng để xác định số mol và chất rắn không tan thu được.
Cho 36 gam hỗn hợp Fe3O4 và Cu vào dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn không tan là 6,4 gam. Phần trăm khối lượng Fe3O4 trong hỗn hợp ban đầu là
A. 25,76%
B. 82,22%
C. 64,44%
D. 32,22%
Đáp án C
Ta có
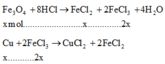
→ nCu = x + 0,1
→ mFe3O4 + mCu = 232x + 64.(x+0,1) = 36 → x= 0,1 → 64,44%
Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 và Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác khử hoàn toàn a gam hỗn hợp A bằng H2 thu được 42g chất rắn. Tính phần trăm khối lượng Cu trong hỗn hợp A.
A.44,8%
B.50%
C.32%
D.25,6%
Đáp án A:
Còn lại 1 phần chất rắn không tan => Cu dư

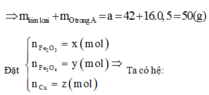
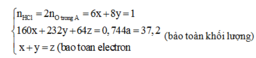
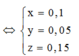
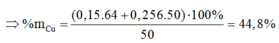
Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4. và Cu vào dung dịch HCl dư thấy có 1 mol axit phản ứng và còn lại 0,256a gam chất rắn không tan. Mặt khác, khử hoàn toàn a gam hỗn hợp A bằng H2 dư thu được 42g chất rắn. Tính phần trăm khối lượng Cu trong hỗn hợp A:
A. 44,8%.
B.50%.
C.32%.
D.25,6%.
Đáp án A
Vì còn lại một phần chất rắn không tan nên Cu dư và trong dung dịch chứa FeCl2 và CuCl2
Có nO(A) = 0,5nHCl = 0,5
a = mkim loại + mO(A) = 42 + 16.0,5 = 50 (gam)
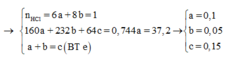
![]()